انواع عقرب
کژدم غیر حفاری است که اندازه آن تا ۶ سانتی متر نیز میرسد.تیره یا قهوهای در سطح (Creast) رنگ بدن زرد با برجستگیها پشتی میباشد و برای همین هم کژدم زرد خالدار نامیده میشود،در بعضی مناطق مانند خوزستان عوام آنرا کژدم توسن مینامند .این گونه براحتی درا ماکن مسکونی زندگی میکند و فراوانترین گونه درسرتاسر کشوراست که درا ماکن ا نسانی بسر میبرد در میان نمونههای مورد بررسی فرمهای متفاوت ریختی نیز دیده شده است .با توجه به اینکه این گونه در زمره کژدمهای مهم ایران از نظر فراوانی گزش طبقه بندی شده است ، نیاز به مطالعات دقیقتری در مورد پرورش عقرب دارد .
این کژدم ، با ٢١.٧درصد و با فاصله کمی از همیسکورپیوسل پتوروس سومین عامل گزش انسانی در خوزستان بوده است این در حالی است که کژدمهای زرد) مزوبوتوس اپئوس و الیویروس کوکازیکوس (درکاشان % ۶٢ گزشها را صورت دادهاند ) زهر این جانور خطرناک نیست ودرد آن پس از چند ساعت بدون هیچ گونه عارضهای برطرف میشود در مناطق کوهستانی استان مازندران مزوبوتوس اپئوسا پئوس و مزوبوتوسا پئوس فیلیپوویتچسکی گزارش شدهاند که یکجا نقشه سازی شدهاند .
این گونه با تیپهای محلی خود( از مناطق مختلف کشور مانند استانهای خوزستان ( شوش ، ماهشهر،آبادان )، هرمزگان ) بندرعباس (، گلستان ) گرگان (، تهران ) ورامین وکوه های برغان (، کردستان ) سقز، مریوان ، بانه (، کرمانشاه ) سر پل ذهاب ، قصر شیرین ، پاوه (، ایلام ) دهلران ، ایوان ، مهران (، آذربایجان غربی) چالدران ، پیرانشهر، سردشت ، سلماس ، ماکو، خوی، اشنویه ،ارومیه (، خراسان بزرگ ) قوچان ، درگز، سرخس ، نهبندان ، بیرجند،قائن ، خواف ، تایباد، تربت جام (صید شده است .این کژدم که از نظر فراوانی کژدم غالب در استان کهکیلوبه و بویر احمد وشهرستان شیراز گزارش شده.
برای اطلاعات بیشتر به مقاله«جداسازی فراکسیون های سمی زهرعقرب مزوبوتوس اپئوس ایرانی با سه فرایند کروماتوگرافی مختلف» مراجعه فرمایید.
منابع:
سید پژمان شیرمردی، مصطفی عرفانی، عباس زارع میرک آبادی
پژوهشگاه علوم و فنون هسته ای سازمان انرژی اتمی ایران، تهران ، s_shirmardi@gmail.com
در این مطالعه تهیه و جداسازی فراکشن سمی سم عقرب مزوبوتوس اپئوس ایرانی که از خانواده عقرب بوتیده بوده و در سراسر ایران پراکنده می باشد انجام شده است.
زهر عقرب مزوبوتوس اپئوس ایرانی همانند دیگر هم خانواده های عقرب مزوبوتوس اپئوس ایرانی دارای توکسین های مختلف می باشد که بر روی کانال های یونی تاثیرات زیادی دارند.
برای بررسی و مطالعه این توکسینها،زهر عقرب مزوبوتوس اپئوس ایرانی توسط سه مرحله جداسازی کروماتوگرافی به ترتیب ژل فیلتراسیون باسفادکس۵۰-G ،رزین آنیونیDEAE ورزین کاتیونی CM جداسازی سازی شد.درهرمرحله ازجداسازی،هرفراکشن جداسازی شده که توسط فراکشنهایی درطیف UV مشخص گردیدبه۲ موش معمولی ازطریق رگ دم عقرب تزریق وفراکشن سمی آن مشخص شد.سپس برای خالصترنمودن این فراکشن سمی،آن را تغلیظ نموده ومرحله بعدی کروماتوگرافی انجام میشد.
نتایج تزریق فراکشنهای جدا شده نشان داد که نشان داد که فراکشنهای F۳ ،F۳۱ ،F۳۱۶ و F۳۱۹ سمی بوده و باعث
مرگ موشها شدند.
تعیین نقاط هدف و محل تمرکز فراکشنهای سمی زهر عقرب به روند درمان عقرب گزیدگی و طراحی پادزهر مناسب کمک می کند.
مقدمه:
عقرب ایرانی از دو خانواده عقرب اسکرپیونیده و عقرب بوتیده تشکیل شده اند. عقرب مزوبوتوس اپئوس از خانواده عقرب بوتیده می باشد که در قسمت های مختلف کشور پراکنده شده است .در مورد پراکندگی کلی عقرب ایران یادآوری این نکته الزم است که شعاع پراکندگی جغرافیایی تیره عقرب بوتیده در ایران بیشتر است. تیره عقرب اسکرپیونیده محدود به مناطقی از شهرهای جنوب، جنوب غربی، استان مرکزی و استان آذربایجان، کرمانشاه، کردستان و خراسان میشود، در حالی که انواع مختلفی از جنسهای تیره عقرب بوتیده از تمام نقاط ایران گزارش شده است. تنوع و پراکندگی وسیع تیره عقرب بوتیده در ایران می تواند نتیجه قدمت بیشتر آن نسبت به تیره عقرب اسکرپیونیده باشد. با توجه به اینکه زهر عقرب مزوبوتوس اپئوس ایرانی(عقرب ایرانی) مرگ آور می باشد، جداسازی و مطالعه اجزای سمی زهر عقرب مزوبوتوس اپئوس ایرانی (عقرب ایرانی )می تواند باعث تهیه پادزهر اختصاصی به منظور ارائه خدمات پزشکی بهتر و مؤثرتر به افراد عقرب گزیده باشد.
.jpg)
.jpg)
در نتیجه هدف از اجرای این تحقیق، ارائه اطلاعات مورد نیاز جهت تهیۀ پادزهرعقرب اختصاصی بوده که بوسیلۀ آن درمان موثری بر روی بیماران عقرب گزیدگی شده انجام خواهد گرفت و راه حل مناسبی برای مقابله با مرگ و میر و عوارض وخیم ناشی از عقرب گزیدگی عقرب مزوبوتوس اپئوس ایرانی خواهد بود. اخیرا در مرکز سرم سازی رازی اثر زهر عقرب مزوبوتوس اپئوس ایرانی (عقرب ایرانی)بر روی سیستم تنفسی و قلب بررسی گردید.زهرعقرب مزوبوتوس اپئوس ایرانی(عقرب ایرانی) دارای مواد تشکیل دهنده مختلفی از جمله توکسین های متنوع، اسیدهای آمینه، موکوپروتئینها و اولیگوپپتیدها می باشد.عمده تاثیر توکسین ها بر روی مسدود کردن کانالهای سدیمی، پتاسیمی و کلرایدی می باشد. توکسین های با زنجیره بزرگتر از ۶۰ اسید آمینه بیشتر بر روی کانالهای سدیمی و زنجیره های ۳۰ تا ۴۰ اسید آمینه بر روی کانالهای پتاسیم و کلرایدی تاثیر می گذارند.
برای تهیه زهر عقرب خالص تر، از روش تحریک الکتریکی غده سمی نیز استفاده می شود. برای اینکار عقرب زنده را با دو پنس مناسب از ناحیة سر و دم عقرب مهار و نیش عقرب را وارد ظرف شیشه ای کوچک می کنند، دو سر الکترود دستگاه الکتروشوک را برای لحظه ای در طرفین غده سمی عقرب قرار می دهند. در اثر عمل انقباض عضالت وابسته، سم عقرب البته خالص داخل ظرف پاشیده می شود. ترشحات اولیه زهرعقرب، زلال و شفاف است ولی بتدریج کدر و چسبناک می شود.در این حالت زهرعقرب با مخاط مخلوط شده است. مقدار ولتاژ و فرکانس الزما برای تحریک الکتریکی بسته به نوع عقرب متفاوت است. معمولا ولتاژهای ۶ تا ۱۰ ولت قادر است سم عقرب البته خالص ان را به صورت شفاف بدست دهد. در ولتاژهای بالاتر، امکان ترشح مخاط افزایش می یابد.زهرعقرب حاصل از هریک از دو روش را می توان در حالت انجماد و خلأ خشک کرده و بصورت پودر درآورد. از دیسیکاتور نیز برای خشک کردن محلول زهرعقرب می توان استفاده کرد. در این حالت سم خشک عقرب شده بصورت کریستال درمی آید. زهر عقرب حاصل در شیشه های دربسته و در محلی خشک و تاریک نگهداری میشود. ۲ الی ۴ درجه سانتیگراد، درجه حرارت مناسبی برای نگهداری طولانی زهرعقرب است.زهرعقرب باید از گونه و در صورت امکان از زیرگونه های یکسان، که همگی متعلق به یک جمعیت و یک ناحیه باشند انجام شود. زهرعقرب ماده ای است پروتئینی، در حالت تازگی و خلوص، شفاف و بیرنگ و با pH برابر خنثی تا قلیایی است. پودر آن سفید تا کرم روشن و کریستال آن زرد رنگ است.
.jpg)
فراکشن های سمی (Toxic )زهر عقرب را می توان با استفاده از روشهای الکتروفورز، کروماتوگرافی و همچنین فیلتراسیون روی ژل سفادکس اززهر عقرب جدا کرد. وسیع ترین تکنیک مورد استفاده برای خالص سازی توکسینهای زهر عقرب شامل استخراج محلول سم خام عقرب در طی انحلال در آب و سانتریفوژ کردن و به دنبال آن کروماتوگرافی ستونی است. توکسینها پلی پپتیدهای بازی هستند بنابراین یک رزین تعویض کننده کاتوینی مانند کربوکسی متیل سلولز برای مرحلة دوم خالص یک مرحله سازی مناسب و کافی به نظر می رسد ولی معموال سوم کروماتوگرافی برای اینکه توکسین ها در شکل هموژن بدست آیند، لازم می شود.
پس از استخراج زهر عقرب توسط روش شوک الکتریکی، آن را لیوفیلیزه نموده و در فریزر نگهداری می شود. سپس برای انجام این کار ابتدا مقداری از پودر لیوفیلیزه سم خام عقرب مزوبوتوس اپئوس که توسط روش تحریک شوک الکتریکی بدست آمده بود در آب مقطر حل و به مدت ۳ ساعت به هم زده می شود. سپس این محلول بمدت ۴۸ ساعت درون کیسه دیالیز و در سردخانه با دمای حدود ۴درجه سانتیگرادقرار گرفت. کیسه دیالیز ۳۲میلی متر جهت این کار استفاده می شود. پس از دیالیز، نمونه مورد نظر بمدت ۱۷ دقیقه در سانتریفوژ SIGMA ۶K۱۵ ساخت کشور آلمان و روتور ۱۲۱۷۲و با۱۴۰۰۰ دور در دقیقه و دمای ۴درجه سانتیگراد سانتریفوژ شد و قسمت محلول از موکوپروتئینهای نامحلول جدا گشت، حضور موکوپروتئین ها موجب سد شدن ستون ژل خواهد شد. بعد از سانتریفوژ نمودن محلول از فیلتر ۴۵/۰ میکرومتر عبور داده می شود.

برای انجام این مرحله ابتدا ستون شیشه ای به ابعاد cm۱۲۵*cm۵/۲ انتخاب و با سفادکس ۵۰-G متورم شده پر گردید. سپس به مدت ۲۴ ساعت بافر استات آمونیوم ۱/۰ موالر با ۶=/۸pH ً از روی آن عبور داده شد تا ستون کاملا شرایط الزم برای جداسازی را کسب کند.بافر استات آمونیوم یک بافر فرار می باشد، بنابراین فراکشن های جمع آوری شده را می توان به راحتی و به سرعت تغلیظ و یا لیوفیلیزه کرد. بعد از آن مقدار ۲۰۰ میلی گرم از سم عقرب لیوفیلیزه شده ای که موکوپروتئینهای آن جدا شده بود در ۱۸ میلی لیتر آب مقر حل شده و روی ستون برده شد و با سرعت hr/ml ۶۰ توسط بافر آمونیوم استات اولیه در حجم های ۱۰ میلی لیتری در ۱۲۷ لوله آزمایش جداسازی و جمع گردید. سپس جذب لوله ها در دستگاه UV در طول موج nm۲۸۰( که حداکثر جذب پروتئین ها در این طول موج میباشد.) خوانده شد و منحنی جذب لوله ها در برابر شمارة آنها رسم گردید (شکل۱.) در این نمودار ۴ فراکشن مجزا قابل مشاهده است.محتویات لوله هایی که مربوط به هر فراکشن بود مخلوط گردید و جهت تعیین سمیت فراکشن ها از هر کدام به میزان ۵/۰ میلی لیتر به رگ دم موش تزریق شد و فراکسیون سم عقرب که سبب مردن موش شد جهت تغلیظ و آماده شدن برای مراحل بعدی کروماتوگرافی کنار گذاشته شد. مالک سمی عقرب (Toxic )فراکشن های بدست آمده در انجام این آزمایش، کشنده بودن فراکشن برای موش نرمال بوده است. این بر اساس مشاهدات و روش کار میراندا در سال ۱۹۷۰ می باشد. در این کار هریک از ۴ فراکسیون به ۲ موش تزریق شد و سمیت فراکشن شماره ۳ با کشتن هر دو موش نرمال مشخص گردید (جدول۱ .)

قابل ذکر است موش ها به مدت ۲۴ ساعت در قفس نگه داشته شدند تا بطور قطع کشنده بودن توکسین ها دیده شود اما ملاحظه شد که فراکشن های دیگر بعد از گذشت ۲۴ ساعت اثر کشندگی نداشتند. این نکته قابل ملاحظه بود که قبل از مرگ، موش ها فلج می شدند. جهت اطمینان از کشنده بودن فراکشن ها و اطمینان از اینکه دخالت و حضور بافرها باعث کشندگی نشده است در این آزمایش سعی شد تا کشنده بودن و یا سمی بودن فراکشن ها قبل و بعد از دیالیز بررسی شود. لذا بافر استات آمونیوم به تنهایی تزریق شد و نتیجه آزمایش اثبات نمود که اثر کشندگی تنها مربوط به فراکسیون های سمی می باشد و بافر دخالتی ندارد. از آنجا که هدف ما در انجام این کار جداسازی توکسین های موثر روی پستان داران بوده است، بدیهی است که غیر سمی(Nontoxic )بودن فراکشن های دیگر بعلت عدم قدرت کشندگی روی موش دلیل بر نفی وجود فعالیت های احتمالی دیگر مثال روی حشرات یا دیگر گروههای طبقه بندی کننده توکسین های عقرب نمی باشد.
ابتدا رزین DEAE را در آب ریخته و به حجم ۲۰۰ سی سی می
رسانیم سپس مقدار حدود ۱۱ گرم NaCl جهت ایجاد محلول
۱ موالر به آن اضافه می شود و به مدت ۳۰ دقیقه محلول به
خوبی به هم زده می شود. بعد از آن رزین ته نشین شده و
آب نمک روی ژل قرار می گیرد و به راحتی می توان آن را
خارج کرد. برای تزریق رزین به ستون ابتدا کمی پشم شیشه ته
لوله قرار داده تا رزین از ستون خارج نشود، سپس حدود یک
سوم ستون را آب ریخته و آرام رزین به ستون تزریق می شود.
کنترل هدایت (Conductivity )خروجی و ورودی الزامی می
باشد، (ورودی ۳ میکرو زیمنس و خروجی ۳۰ می باشد). بافر
این ستون تریس باز ۲۰میلی مولار است که با افزودن مقداری
اسید کلریدریک pH آن روی ۳/۸ تنظیم می شود. جهت افزایش
قدرت یونی از گرادیان نمک نیم مولار استفاده می شود و میزان
۵۰۰ میلی لیتر از هر کدام تهیه می شود و بصورت سری قرار
می گیرند.
پمپ و دستگاه Collector Fraction روی سرعت ۲۰ میلی لیتر
بر ساعت و ۵ میلی لیتر در هر لوله، تنظیم شده سپس۵۰ میلی
لیتر از محلول فراکشن ۳ که از مرحله قبل سمیت آن احراز شده بود آماده و به ستون تزریق می شود. پس از شستشوی
کامل ستون رزین، طیف UV لوله های پرشده مشخص گردید
و نمودار آن رسم (شکل ۲ )وفراکسیون های سمی و غیر سمی
مشخص شد. در این قسمت از خالص سازی ۳ فراکشن مشاهده
شد که به ازای هر فراکسیون ۲ موش جهت تعیین فراکشن های
سمی انتخاب و فراکشن شماره یک (F۳۱)سمیت خود را نشان
داد (جدول۲).

آماده سازی ستون کاتیونی
در این قسمت همانند روش قبل ابتدا ژل CM توسط نمک یک
مولار آماده می شود. سپس بافر سدیم استات ۲۰ میلی موالر با
pH برابر ۸/۴ به همراه گرادیان نمک نیم موالر تهیه می شود.
پمپ و دستگاه Collector Fraction را روی سرعت ۲۰ میلی
لیتر بر ساعت و ۵ میلی لیتر در هر لوله تنظیم وسپس۴۴ میلی
لیتر محلول فراکسیون (F۳۱ )که از مرحله قبل آماده شده بود
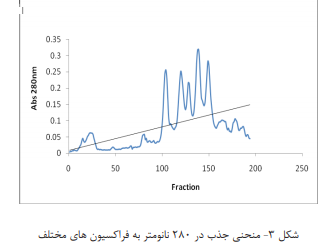
به ستون تزریق می شود. بعد از شستشوی کامل ستون و جمع
آوری خروجی، طیف UV آن مشخص و نمودار را رسم شد(شکل ۳ ).مقادیر هر فراکسیون که در لوله های مختلف قرار
دارند روی هم ریخته شده و به مدت ۲۴ ساعت دیالیز می شوند.
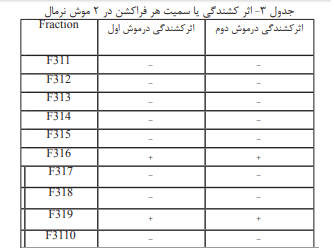
در این قسمت از خالص سازی ۱۰ فراکسیون مشاهده شد که با
تزریق هر فراکسیون به ۲ موش نرمال فراکشن ۶و۹ سمی بودند
(جدول ۳).
تحقیقات متعددی جهت بررسی فعالیت های بیولوژیکی زهر عقرب ،حشرات و خزندگان مختلف بر روی حیوانات آزمایشگاهی انجام شده است و ثابت شده است که تاثیرات زهر عقرب بیشتر به پپتیدهایی با وزن پایین است .بررسی زهر عقرب ایرانی و همچنین جداسازی فراکشن های سم عقرب این امکان را به محققان خواهد داد تا بتوان با شناخت محل تمرکز فراکشن های سمی در بدن و مسیر توزیع آنها به اقدامات درمانی و طراحی پادزهرهای مناسب عقرب گزیدگی دست یابند.با توجه به گستردگی گونه های مختلف عقرب در کشور، جداسازی فراکشنهای سمی زهر گونه های مختلف عقرب ایرانی (مزوبوتوس اپئوس ایرانی )بخصوص خانواده عقرب بوتیده از اهمیت ویژه ای برخوردار است. زهر عقرب های خانواده عقرب بوتیده بیشتر از پپتیدهای نوروتوکسیک و پپتیدهای کوچک دیگری که عملکرد مشخصی ندارند تشکیل شده است. با توجه به پراکندگی زیاد زهر عقرب مزوبوتوس اپئوس ایرانی (عقرب ایرانی )در کشور و اهمیت شتاخت هرچه بیشتر زهر عقرب مزوبوتوس اپئوس ایرانی (عقرب ایرانی )تلاش شد در موسسه سرم سازی کرج زهرعقرب توسط روش شوک استخراج و سپس لیوفیلیزه گردید.
.jpg)

البته روش های استخراج زهر کژدم متفاوت بوده که دو روش عمده آن روش شوک الکتریک و روش سایش غدد می باشد. تجربه نشان داده که روش اول مناسب تر بوده و پروتئین های بزرگی همچون موکوها کمتر در زهر ترشح می شوند. پس از گرفتن زهر عقرب و لیوفیلیزه کردن آن، حدود ۲۰۰ میلی گرم از آن را جهت بررسی و جداسازی برداشته شد. برای جداسازی ۳ مرحله در نظر گرفته شد. در مرحله اول کروماتوگرافی )ژل کروماتوگرافی( ۴ فراکشن به دست آمد که با تزریق هرکدام از آنها به ۲ موش نرمال و مردن هر دو موش سمیت فراکشن F۳ که سومین پیک طیف UV بود مشخص گردید. سپس این فراکشن سمی را بر روی ستون رزین آنیونی بارگذاری کرده که ۳ فراکشن مشاهده شد. با تزریق به موش، فراکشن اول طیف، F۳۱ سمی بود. در ادامه این فراکشن بر روی ستون رزین کاتیونی بارگذاری شد که در طیف خروجی ۹ فراکشن مشاهده شد که فراکشن ۶ و۹ ( F۳۱۹,F۳۱۶ )سمی بودند. با توجه به نتایج به دست آمده می توان با خالص سازی تکمیلی توسط HPLC به فراکشن های خالص تری دست یافت و در ادامه توالی اسیدهای آمینه پپتیدهای موجود در فراکشن سمی را برای مطالعات تکمیلی تعیین نمود.
با خالص سازی های بیشتر می توان به توالی اسیدهای آمینه این فراکشن ها دست یافت و از این طریق به پادزهرهای اختصاصی تر رسید. از پپتیدهای موجود در زهر عقربها نیز جهت درمان تومورهای سرطانی می توان استفاده کرد و همچنین از روغن عقرب. با اعمال فرایندهای جداسازی مختلف مشاهده شد که در مرحله اول خالص سازی یک فراکشن سم عقرب ، در مرحله دوم یک فراکشن و در مرحله سوم دو فراکشن سم عقرب استخراج گردید. با توجه به شناخت این فراکشن ها می توان با تحقیقات بیشتر توالی اسیدهای آمینه آنها را به دست آورده و پادزهر مناسبی برای آنها بصورت اختصاصی تهیه کرد.